Съдържание
- инструкции
- Брой на електроните във валентния слой
- Структурата на Луис
- Формален заряд на всеки атом
- предупредителен
- Какво ви трябва
Когато се определя формалният заряд на молекула като CoCl2 (фосгенов газ), е необходимо да се знае броят на електроните във валентния слой на всеки атом и структурата на Луис на молекулата.
инструкции

-
Потърсете всеки атом в периодичната таблица на елементите, за да определите броя на електроните във валентния слой.
-
Припомнете си, че два електрона са в първото под-ниво s, два са във второто под-ниво s, шест електрона в първото подниво p и така нататък. Спомнете си: 1s (^ 2) 2s (^ 2) 2p (^ 6) 3s (^ 2) 3p (^ 6).
-
Удари товара. Ако молекулата е йон, добавете или извадете един или повече електрони от общата сума, за да достигнете крайния заряд.
-
За CoCl2 (фосгенов газ): С = 4; О = 6; Cl = 7. Молекулата не е йонизирана и има неутрален заряд. Следователно общият брой на електроните в валентния слой е 4 + 6 + (7x2) = 24.
Брой на електроните във валентния слой
-
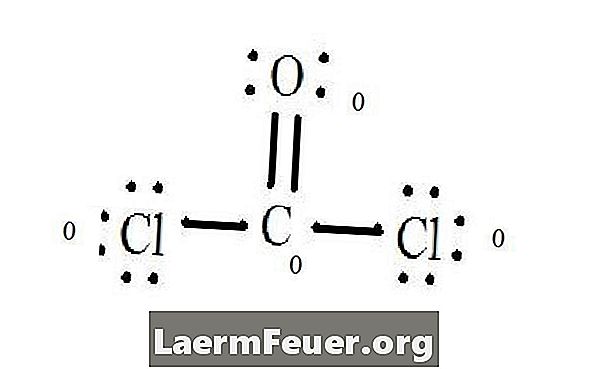
Виж структурата на Люис на CoCl2 (фосгенов газ). Структурата на Люис представлява най-стабилната и вероятна структура на молекулата. Атомите се изтеглят с двойки валентни електрони; между свободните електрони се образуват връзки, за да се изпълни правилото за октета.
-
Начертайте всеки атом и неговите валентни електрони и след това образувайте връзки, когато е необходимо.
Електроните, извлечени от структурата на Луис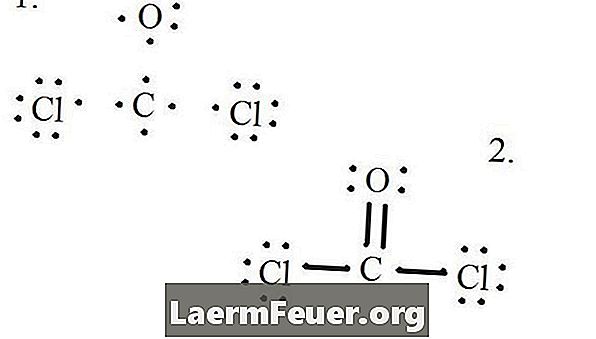
-
Хлоридните атоми споделят единични връзки с въглеродната молекула, докато кислородният атом образува двойна връзка с въглерода. Всеки атом в крайната структура удовлетворява правилото за октета и има осем електрона във валентния слой, което позволява молекулярна стабилност.
Структурата на Луис
-
Изброявайте свободните електронни двойки от всеки атом в структурата на Луис. Всеки атом обозначава електрон от всяка връзка, от която участва. Добавете тези номера. В CoCl2: C = 0 свободни двойки плюс 4 свързващи електрона = 4 електрона. O = 4 електрона на свободните двойки плюс 2 електрона на връзките = 6 електрона. Cl = 6 електрона на свободните двойки плюс един електрон на една връзка с C = 7 електрона.
-
Извадете количеството на електроните в валентния слой върху несвързания атом. Резултатът е формалният заряд за всеки атом. В CoCl2: C = 4 валентни електрони (ev) в несвързания атом минус 4 електрона, определени в структурата на Луис (LS) = 0 формален заряд O = 6 ev - 6 LS = 0 формален заряд Cl = 7 и - 7 LS = 0 формална такса
Формални заряди на атомите
-
Когато пишете, поставете тези заряди близо до атомите в структурата на Луис. Ако в общи линии молекулата има заряд, поставете структурата на Луис в скоби, като зарядът е записан отвън в горния десен ъгъл.
Формален заряд на всеки атом
предупредителен
- Изчисляването на формалния заряд за молекули, съдържащи преходни метали, може да бъде коварно. Броят на електроните в валентния слой за преходните метали ще бъде този, който е извън модела на благородния газ.
Какво ви трябва
- Периодична таблица на елементите