
Съдържание
Броят на йони в съединението зависи от структурата на съединението и от окислителните числа на елементите в него. Окислителният брой на елемента е броят на електроните, които един атом има или се нуждае от броя на протоните в неговото ядро. Това определя йонния заряд на атома, тъй като е от съществено значение за описване на йонните съединения, които образува с други атоми
инструкции
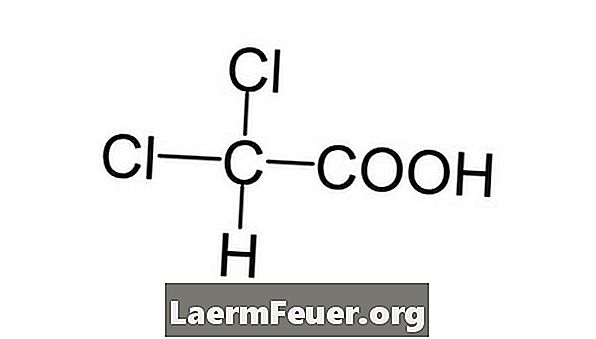
-
Напишете химичната формула за въпросното съединение.
-
Идентифицирайте многоатомните йони в съединението. Многоатомните йони са йонни молекули, съставени от повече от един атом (обикновено повече от един елемент). Вижте справочниците за списъка на общите многоатомни йони и техните заряди.
-
Разделете катионите и анионите. Катионите са положително заредени йони, анионите са отрицателно заредени йони. Например, FeSO (4) (желязо (II) сулфат) съдържа железен катион (Fe + 2) и анион сулфат (SO (4) -2). Важно е да се отбележи, че сулфатът е многоатомният йон, а не набор от пет различни йона. Римската цифра "II" показва +2 броя окисление на желязото. Това му позволява да се свързва само с един сулфатен анион.
Ако химически символ има експонентен асоцииран с него, има няколко атома от този елемент в съединението. Освен ако не са част от многоатомния йон, всеки атом от този елемент е индивидуален йон. Например, желязо (III) сулфат се записва като Fe2 (SO4) 3. +3 окислителният брой на желязото изисква различен брой сулфати за йонно свързване. В този случай два железни (III) йона се свързват с три сулфатни йона.
-
Добавете общия брой катиони и аниони. Железният (II) сулфат, например, има два йона: катион на желязо и сулфатен анион.
съвети
- Като цялостното разбиране на окислителните числа ще ви помогне да разчетете йонната природа на съединението бързо и уверено.
Какво ви трябва
- Периодична таблица