
Съдържание
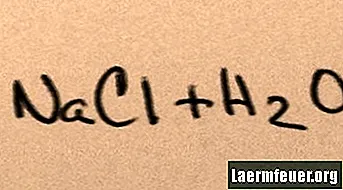
Когато солта се добави към водата, тя се разтваря в съставните си молекули, докато максималните солни йони, които водата може да поддържа, се носят около молекулите на водорода и кислорода. Когато това се случи, разтворът се нарича "наситен". Когато се разтвори повече сол, натриевите и хлоридните йони се сблъскват помежду си и се рекомбинират в солни кристали. Това явление е известно като „валежи“, тъй като образуваното твърдо вещество пада на дъното на водата. Солите са "хидрофилни", тоест те са привлечени от водата. Тази атракция улеснява познатата форма на валежите: дъждовните капки се образуват около малки кристали сол в облаците, което я прави леко солена.
Основното

Електролити

Солта не провежда електричество в твърдо състояние, но в течно (течно) състояние образува решение, което може да проведе електричество много добре. Проводимостта зависи от вида на използваната сол, но тези течности, наречени електролитни разтвори, са отлични носители на съединения, необходими на човешкото тяло. Електрическите импулси, генерирани от мозъка, произвеждат свободен кислород, който се използва от кръвта. Молекулите на солта се класифицират в електролити (натрий, калий или калций) и хлориди в разтвор: хлоридът се изпомпва от кръвта и бъбреците в урината, а електролитите се разпределят през нервно-мускулната система в процес, който спортистите наричат рехидратация.
Колигативни свойства

Всеки разтвор се различава от първоначалния си състав, защото добавянето на молекули, дори когато те не образуват нови съединения, променя молекулното тегло на течността и влияе върху нейните свойства. Солената вода е по-плътна от чистата вода и също така замръзва по-бавно. Докато замръзва обаче, солта мигрира до границите на течността, което я прави по-тежка и наситена и след това понижава точката на замръзване. В другия край на вещественото състояние, колкото по-плътна е солената вода, толкова повече топлина й е необходима, за да се изпари, докато водата изтече, оставяйки слой сол. Готвачи изчакват водата в тенджерата да заври, за да добавят сол, за да не забавят нагряването. Тези качества, известни като „колигативни свойства“, помагат на учените да определят молекулното тегло на солената вода. Ако масата, атмосферното налягане и точката на кипене на течността могат да бъдат измерени, тогава учените могат да извадят молекулното тегло на водата, за да разберат кои соли присъстват.